Erhalten Sie exklusiven Zugang zu Promotion-Codes, Angeboten und neuen
Produkten.
Fokus auf Fisherbrand mit einer Auswahl an hilfreichen Produktressourcen wie Bedienungsanleitungen, FAQ’s, Leitfäden zur Fehlerbehebung, Auswahlhilfen, Kompatibilitätstabellen und Workflows. Fisherbrand, Fisher Chemical und Fisher BioReagents bieten Ihnen zuverlässige Produkte für Ihren Laborbedarf, damit Sie tagtäglich die besten Ergebnisse erzielen.
A. Die Art des Puffers, der in der Agarose-Gelelektrophorese verwendet wird, hängt hauptsächlich von der Größe des DNA-Fragments und der Postelektrophorese-Anwendung ab. Zwei üblicherweise für die DNA-Agarose-Elektrophorese verwendete Puffer sind Tris-Acetat mit EDTA (TAE; 40 mM Tris-Acetat, 1 mM EDTA) und Tris-Borat mit EDTA (TBE, 89 mM Tris-Borat, 2 mM EDTA). Da der pH-Wert dieser Puffer neutral ist, hat das Phosphat-Rückgrat der DNA eine negative Nettoladung und geht zur Anode über.
TAE und TBE haben unterschiedliche Eigenschaften, die den einen Puffer für bestimmte Zwecke geeigneter machen als den anderen. Für größere DNA-Fragmente (>10 kb) wird TAE bevorzugt. Für kleinere DNA-Fragmente (<1 kb) wird im Allgemeinen TBE bevorzugt, da es eine höhere Pufferkapazität aufweist und für eine schärfere Auflösung als TAE sorgt. TAE ist auch die bevorzugte Wahl für Puffer, wenn die DNA-Probe bei Klonexperimenten verwendet werden soll, da das Borat im TBE-Puffer für viele Enzyme ein starker Inhibitor ist.
A. Die empfohlene Dicke für Agarosegel beträgt 3 bis 4 mM. Gele, die dicker als 5 mM sind, führen zu unscharfen Banden.
A. Fisher BioReagents Art. Nr. 10766834 Agarose mit der Reinheit für die Molekularbiologie, eignet sich gut für die Routinetrennung von DNA und RNA im Bereich von 500 bp bis 23 kb. Für die Trennung von Fragmenten im Bereich von 100 bis 2000 bp empfehlen wir Fisher BioReagents Art. Nr. 10766834 zur Erhöhung der Gelkonzentration (>2 %) und die Verwendung von TBE als Puffer (nicht TAE).
A. Die Comet-Assay-Elektrophorese (Einzelzell-Gelelektrophorese) ist eine einfache Methode, um DNA-Strangbrüche in eukaryotischen Zellen zu messen. Normalerweise wird Agarose mit niedrigem Schmelzpunkt benötigt. Wir empfehlen Fisher BioReagents Art. Nr. 10377033, da es sich dabei um Agarose mit niedrigem Schmelzpunkt handelt, die ideal für die Trennung und Gewinnung von Nukleinsäuren ist.
A. Sie sollten nicht mehr als 100 ng DNA laden. Diese Menge sollte für eine klare, klar definierte Bande sorgen, wenn sie mit Ethidiumbromid gefärbt und unter UV-Licht betrachtet wird. Wenn Sie zu viel DNA laden, sind Verschmierungen zu sehen.
A. Die gefärbten Ladepuffer in Fisher BioReagents Art. Nr. 10205023, gefärbter Ladepuffer für Agarosegel, 6X, sind eine einzigartige Mischung aus drei Tracking-Farbstoffen, die eine einfache und zuverlässige Schätzung der Probenmigration ermöglichen:
A. Die empfohlene Spannung beträgt 4 bis 10 Volt/cm (cm wird durch Messen des Interelektrodenabstandes, d. h. des Abstands zwischen Anode und Kathode, nicht der Länge des Gels) unter normalen elektrophoretischen Bedingungen bestimmt. Wenn die Spannung zu niedrig ist, wird die Beweglichkeit von kleiner DNA (<1000 bp) reduziert und aufgrund von Diffusion tritt eine Bandenverbreiterung auf. Wenn die Spannung zu hoch ist, wird die Bandauflösung reduziert, hauptsächlich wegen einer Überhitzung des Gels.
A. Umwälzung verhindert die Bildung von pH-Gradienten und Pufferausscheidung, daher ist es ratsam, den Puffer vor allem bei längerer Elektrophorese umzuwälzen. Die Pufferumwälzung ist auch wichtig, wenn aufgrund der geringeren Pufferkapazität von TAE größere TAE-Gele verwendet werden.
A. Dazu sind Ethidiumbromid-Entfärbungsbeutel erhältlich, Fisher BioReagents Art. Nr. 12861680. Diese Beutel entfernen bis zu 5 mg Ethidiumbromid, wenn sie über Nacht mit der Lösung verrührt werden. Da die Entsorgungsvorschriften jedoch variieren, wenden Sie sich bitte bezüglich der Entsorgungsrichtlinien an Ihren Sicherheitsbeauftragten vor Ort.
A. Wir haben keine Informationen bezüglich der Menge an DNA in jedem einzelnen Fragment (Bande) von Fisher BioReagents Art. Nr. 10284633, Low Scale DNA-Leiter (100 bp). Diese DNA-Leiter soll ein allgemeiner Größenstandard für DNA-Fragmente wie PCR*-Amplikons sein, die auf Agarose-Mini-Gel separiert werden. Sie ist nicht als quantitativer Standard gedacht. Zur Quantifizierung gibt es jedoch die exACTGene DNA-Leitern wie Fisher BioReagents Art. Nr. 10021463; diese Low Range Plus DNA-Leiter liefert die ungefähre Menge an DNA in jeder Bande.
A. Bei der Auswahl des Acrylamid-Prozentsatzes oder der Porengröße des zu verwendenden Gels ist Vorsicht geboten. Die nachstehende Tabelle gibt an, welcher Gel-Prozentsatz zur Trennung der angegebenen Proteingrößen verwendet wird.
| Acrylamid-Prozentsatz | Trennauflösung |
| 5% | 60 to 220kDa |
| 7.5% | 30 to 120kDa |
| 10% | 20 to 75kDa |
| 12% | 17 to 65kDaa |
| 15% | 15 to 45kDa |
| 17.5% | 12 to 30kDa |
A. Für die Proteingel-Elektrophorese sind typische Probenladepuffer entweder in einer reduzierenden oder nicht-reduzierenden Formulierung erhältlich. Dithiothreitol (DTT) ist ein übliches Reduktionsmittel, das in Proteinprobenpuffern verwendet wird. Die Formulierung von Fisher BioReagents Art. Nr. 10376363, Proteingel-Ladepuffer (2X), enthält keine Reduktionsmittel wie DTT.
A. Es wird nicht empfohlen, Fisher BioReagents Art. Nr. 10204733, 10X PBS, zu autoklavieren, da Phosphat ausfallen kann. Für dieses Produkt filtern wir die Pufferlösung durch einen 0,2 Mikron-Filter unter einer sterilen Haube in eine sterile 1 l-Polyflasche.
A. Die Formulierung von Fisher BioReagents Art. Nr. 10649743 Phosphate Buffered Saline (PBS), 10X, (phosphatgepufferte Salzlösung) lautet wie folgt:
A. Western Blot basiert auf der Separation von Proteinen auf einem Gel nach ihrer Größe. Die Migration von Proteinen durch die Gelmatrix wird jedoch auch durch andere Faktoren beeinflusst, die dazu führen können, dass die beobachtete Bandengröße von der vorhergesagten Größe abweicht. Häufige Ursachen sind:
A. Die Coomassie-Färbung ist wahrscheinlich eine der bekanntesten Proteinfärbetechniken. Es gibt zwei Coomassie-Färbeverfahren, die „klassische“ Coomassie-Färbung und die kürzlich entwickelte kolloidale Coomassie-Färbung.
A. Ja, es ist möglich, vor dem Western Blot mit Coomassie oder Coomassie Blue zu färben, obwohl eine Verminderung der Übertragung und der anschließenden Untersuchungseffizienz auftreten kann. Es muss jedoch beachtet werden, dass dies in der Regel nur empfohlen wird, wenn Sie die kolloidale Färbung verwenden. Um eine optimale Übertragungseffizienz sicherzustellen, sollte das Gel entfärbt und anschließend in einer Reihe von Tris-Base/Glycin/SDS-Lösungen äquilibriert werden, um die Löslichkeit zu erhöhen. Wenn die Übertragung abgeschlossen ist, sollte die Membran mit Methanol behandelt werden, um die Verfärbung vor der chromogenen Entwicklung zu entfernen. (Vor der chemilumineszenten Detektion ist dies nicht notwendig.)
A. Hier sind einige Optionen, um für größere Proteine eine effizientere Übertragung zu erreichen:
A. Es gibt zwei Faktoren zu beachten: schlechte Übertragung und wenn die Leiter während der Übertragung durch die Membran passiert. Berücksichtigen Sie bei schlechter Übertragung auf die Membran Folgendes:
A. Der am häufigsten verwendete Puffer ist der RIPA-Puffer mit SDS. Die übliche Formulierung lautet wie folgt: 150 mM NaCl, 10 mM Tris, pH 7,2, 0,1% SDS, 1,0% Triton X-100, 1% Desoxycholat, 5 mM EDTA Protease-Inhibitoren: 1 mM Phenylmethylsulfonylfluorid, 10 mM Benzamidin, 2 μg/ml Leupeptin Phosphatase-Inhibitoren: 100 μM Natriumorthovanadat, 10 mM p-Nitrophenylphosphat
A. Optimieren Sie die Konzentration von primären und sekundären Antikörpern. In einigen Fällen reduziert die Erhöhung der Konzentration des Blockierungsmittels (BSA oder fettfreie Trockenmilch) das Hintergrundsignal. Nach Inkubation mit dem primären Antikörper mindestens zweimal mit TBST waschen (dabei in einem oder mehreren der Waschschritte 0,5 M NaCl einschließen). Vermeiden Sie Nonidet™ P40 oder Triton™ X-100 in Puffern, da diese Detergentien aufgrund des Proteinnachweises abnehmen.
A. Ja, Art. Nr. 12737119 (Rinderserumalbumin (BSA), Fraktion V, Hitzeschock-behandelt), kann in einer Anzahl von molekularbiologischen Anwendungen einschließlich Western Blots (als Blockierungsmittel) und ELISA und als Stabilisator für enzymatische Reaktionen verwendet werden. Ein anderes neueres BSA-Produkt, das Sie in Betracht ziehen könnten, ist Art. Nr. 12871630 (BSA, Hitzeschock behandelt und Protease-frei). Dieses Produkt wird oft bei RIA und ELISA und als Blockierungsmittel verwendet.
A. Zur Aufbewahrung trocknen Sie den Blot nach der Übertragung an der Luft und legen Sie ihn zwischen zwei saubere Blätter Filterpapier. Legen Sie das Sandwich aus Blot und Filterpapier zwischen zwei Kartonbögen, um es flach zu halten, und legen Sie es in einen verschließbaren Plastikbeutel. Der Blot kann bei 4°C für bis zu zwei Wochen, bei -20°C für bis zu zwei Monate oder bei -80°C unbegrenzt gelagert werden. Zur Neuverprobung benetzen Sie den Blot zuvor einige Sekunden mit Alkohol, gefolgt von einigen Spülungen mit reinem Wasser, um die Alkoholkonzentration zu reduzieren.
A. Leistung (W) = Spannung (V) x Strom (A)
Widerstand (Ω) = Spannung (V) / Strom (A)
A. Der Widerstand einer Elektrophorese-Einheit hängt von ihrer Größe, der Geldicke, der Puffermenge, der Pufferleitfähigkeit und der Temperatur ab. Dieser Widerstand nimmt normalerweise aufgrund einer langsam ansteigenden Temperatur mit der Zeit ab. Elektrophorese-Einheiten, deren Widerstand unterhalb des Mindestlastwiderstands einer Stromversorgung liegt, lösen einen Alarm aus! Lesen Sie die Ausgangsspannung und den Strom während einer Analyse ab, um den Widerstand zu messen, und verwenden Sie die obige Formel, um den Wert zu berechnen.
A. Entweder stimmen Ihre programmierten Parameter nicht mit den beschriebenen Parametern überein oder der Widerstand Ihrer Elektrophorese-Einheit ist anders (siehe oben). Der Unterschied kann z. B. nicht auf ein anderes Modell der Stromversorgung zurückzuführen sein, da das Verhältnis zwischen Spannung, Strom, Leistung und Widerstand von jedem Gerät auf dieselbe Weise überwacht wird.
A. Wenn die Ausgänge parallel sind, wird jede Elektrophorese-Einheit mit genau der gleichen Spannung versorgt. Strom und Leistung können jedoch aufgrund von Unterschieden zwischen den Einheiten abweichen, selbst wenn genau das gleiche Modell, Gel, Puffer usw. verwendet wird. Daher wird empfohlen, mehrere Elektrophorese-Einheiten nur im Konstantspannungsmodus an derselben Stromversorgung zu betreiben.
A. Elektrophorese bei hohen Spannungen erzeugt Wärme. Außerdem erzeugen Puffer mit hoher Leitfähigkeit, wie TAE, mehr Wärme als Puffer mit niedriger Leitfähigkeit. Bei der Agarose-Gelelektrophorese mit Spannungen über 175 V ist Vorsicht geboten, da durch Wärmeentwicklung Gelartefakte wie S-förmige Migrationsfronten entstehen können und bei ausgedehnten Elektrophorese-Durchgängen sogar das Agarosegel schmelzen kann. Bei der Hochspannungselektrophorese sollte die Verwendung von Agarosegelen mit niedrigem Schmelzpunkt vermieden werden.
A. Hierzu eignen sich eine ganze Reihe von Elektroden. Es ist aber wichtig, dass es sich um eine "Doppelkammerelektrode" handelt. Lesen Sie dazu den ‘Leitfaden zur Auswahl von pH-Elektroden’ auf Seite 26.
A. Nicht alle Elektroden eignen sich für alle Probentypen. Lesen Sie dazu den ‘Leitfaden zur Auswahl der richtigen pH-Elektrode’ auf Seite 26 oder wenden Sie sich im Zweifelsfall an das Produkt-Support-Team von Fisher Scientifi c.
A. Standardelektroden verwenden Silberionen in ihrem Referenzsystem. Proteine, Tris-Puffer und allgemeine biologische Proben reagieren mit Silberionen. Diese Reaktion kann dazu führen, dass sich die Lebensdauer der Elektrode verkürzt.
A. Es sollten stets frische (vorzugsweise nach einem bekannten Standard zertifi zierte) Pufferlösungen verwendet werden. Auch das Alter einer Elektrode sollte in Betracht gezogen werden. Elektroden haben eine Nutzungsdauer von circa 6 Monaten bis einem Jahr und sollten als Verbrauchsgüter behandelt werden.
A. Um genaue und zuverlässige Messwerte zu garantieren, empfehlen wir immer in drei pH-Puffern zu kalibrieren, normalerweise pH 4, 7 und 10. Je nach Genauigkeit Ihrer aktuellen Anforderung, kann dies aber auch an nur zwei pH-Punkten (z.B. 4 und 7 oder 7 und 10) oder bis zu fünf Punkten an accumlet Messgeräten von Fisherbrand erfolgen. Bei der Auswahl der Auswahl der pH-Puffer ist daran zu denken, dass sie den typischen pH-Bereich abdecken, den Sie für Ihre Proben erwarten. Niemals an Punkten zu kalibrieren, die mehr als 3 pH-Einheiten auseinander liegen (Kalibrieren an 4 und 10 z.B. wird keine guten Ergebnisse liefern). Kalibrieren Sie stets unabhängig an pH7.
A. Das Messgerät sollte regelmäßig mit frischen Puffern kalibriert werden. Wenn es täglich/wöchentlich verwendet wird, sollte dies vor jeder Verwendung geschehen. Wenn das Messgerät täglich über den ganzen Tag verwendet wird, sollte es am besten täglich zur Tagesmitte als Teil einer Kalibrierungsroutine kalibriert werden.
A: Der pH-Wert jeder Probe schwankt mit der Temperatur. Für genaue Ergebnisse ist es also am besten auch die Temperatur zu messen. Wenn Sie bei einer anderen Temperatur messen als der auf die Sie das Gerät kalibriert haben, wäre es sinnvoll eine "ATC"- Probe (mit automatischem Temperaturausgleich) oder eine Elektrode mit integriertem ATC zur Messung zu verwenden. Moderne pHMessgeräte passen den Steigungswert der Elektrode bei sich ändernder Temperatur an und gewährleisten so, dass die Messwerte genau bleiben
A. Das ist normalerweise kein Problem. Die große Mehrheit der Hersteller verwendet heutzutage für Standard-pH-Elektroden einen "BNC"-Anschluss zwischen Elektrode und Messgerät für Standard-pH-Elektroden. Dies kann jedoch bei der Verwendung einer ATCSonde kann dies jedoch problematisch sein, da diese Anschlüsse nicht genormt wurden und herstellerspezifi sch sind.
A. So regelmäßig wie möglich. Reinigung und Wartung der Elektrode helfen mit ihre Lebensdauer zu verlängern. Sie müssen unbedingt darauf achten, eine gereinigte Elektrode nicht in aggressiven Reinigungslösungen eingelegt zu lassen. Dies kann zur Beschädigung der Elektrode führen. Wichtige Punkte zur Erinnerung:
A. Ja, das ist möglich. Wichtig dabei ist die Konstante der Leitfähigkeitsmesszelle (auch als der "K"-Wert bekannt). Für Messung von entionisiertem Wasser wird eine Messzellenkonstante von 0,1 benötigt. Jede Messzellenkonstante hat einen begrenzten Erfassungsbereich. Stellen Sie deshalb sicher, dass Sie eine Konstante auswählen, deren Bereich dem der von Ihnen erwarteten Probenleitfähigkeit entspricht. Nachstehend fi nden Sie Beispiele für Probentypen, ungefähre Leitfähigkeitswerte und geeignete Messzellenkonstanten:
A. Es gibt derzeit noch keine Standardverbindung für Messgeräte und Leitfähigkeitsmesszellen. Alle Hersteller benutzen ein unterschiedliches System. Deshalb wird empfohlen, dass Sie Leitfähigkeitsmesszellen und Messgerät vom selben Hersteller verwenden.
A. Die Temperatur kann wesentlichen Einfl uss auf die Leitfähigkeit haben. Ein Temperaturanstieg wirkt sich enorm auf die chemischen Eigenschaften wässriger Lösungen aus. Dies wiederum verändert die Leitfähigkeit der Lösung bei. Typischerweise schwankt die Leitfähigkeit um 1 bis 3% pro Grad °C
A. Leitfähigkeitsmesszellen stellen minimale Lagerungsanforderungen im Vergleich mit anderen Elektrodentypen. Sie können zwischen den Messungen in entionisiertem Wasser aufbewahrt werden. Über Nacht können sie einfach mit entionisiertem Wasser abgespült und dann trocken gelagert werden.
A. Dies sollte regelmäßig geschehen, wenn möglich vor jedem Gebrauch (möglicherweise als Teil einer täglichen Kalibrierungsroutine).
A. Im Kontext der Messwissenschaft ist es die Rückverfolgbarkeit, sodass das Messergebnis zu einer nationalen Behörde wie zum Beispiel dem National Institute of Standards and Technology (NIST), oder US-Regierungsbehörde innerhalb des Wirtschaftsministeriums, zurückverfolgt werden kann. Es besteht insbesondere eine bekannte, gültige Beziehung zu international oder national anerkannten Standards und eine sorgfältig dokumentierte ununterbrochene Referenzkette zur Vermessungsbehörde. Das Kalibrierzertifi kat ISO 17025, das standardmäßig mit den Geräten geliefert wird, ist in allen europäischen Ländern anerkannt.
A. Jedes Traceable™-Gerät ist mit einer individuellen Seriennummer ausgestattet, kalibriert und zugelassen. Ein Traceable™ Kalibrierzertifi kat mit einer individuellen Seriennummer gibt die Sicherheit, dass ein unabhängiger Prüfer die Methoden, Verfahren, Prüfungen, Techniken und Aufzeichnungspraktiken des Prüfl abors für Kalibrierung überprüft hat. Die American Association for Laboratory Accreditation (A2LA) ist durch bilaterale und multilaterale Vereinbarungen und durch ihre Beteiligung an der Laboratory Accreditation (ILAC) und am Multilateral Recognition Agreement (MRA) weit gehend international anerkannt. Die Geräte müssen vor dem Einsatz nicht vor Ort kalibriert werden, da alle europäischen Regierungsbehörden das Traceable™-Kalibrierungszertifi kat vollständig anerkennen.
A. Die Geräte sind ab dem Herstellungsdatum für zwei Jahre kalibriert. Wir empfehlen Ihnen allgemein, dass Sie bei den Geräten nach dem Versand und der Lagerung eine Gültigkeit von mindestens einem Jahr erwarten können.
A. Genauigkeit ist eine Defi nition zur Genauigkeit des Gerätes im Hinblick auf eine bestimmte Temperatur. Da es sehr unwahrscheinlich ist, dass ein gegebener Wert absolut genau sein wird, wird es im Normalfall mit einer Toleranzreferenz geliefert. Die Toleranz zeigt den Ungenauigkeitswert des Instruments an. Dies bedeutet zum Beispiel bei einem Instrument mit einem Genauigkeitswert von ±1 °C, dass das Display des Geräts bis zu 1 °C mehr oder 1 °C weniger als die tatsächlich gemessene Temperatur anzeigen kann und immer noch innerhalb der Toleranz und Genauigkeit des Gerätes liegt.
A. Die Aufl ösung eines Instruments ist der kleinste auf dem Display angezeigte Wert. Dies bedeutet bei einem Instrument mit einer Aufl ösung von 0,1 °C, dass es eine Ablesung bis zum nächstgelegenen 0,1 °C-Wert (z. B. 8,6 °C) auf dem Display durchführen wird, während ein Instrument mit einer Aufl ösung von 1 °C nur den nächstgelegenen 1 °C-Wert (9 °C) anzeigen wird.
A. Keines der Fisherbrand Traceable™-Produkte muss aufgrund eines Batteriewechsel neu kalibriert oder neu zertifi ziert werden. Diese Geräte sind rückverfolgbar auf NIST-Standards und das Kalibrierzertifi kat ISO 17025, das standardmäßig mit den Geräten geliefert wird und in allen europäischen Ländern anerkannt ist.
A. Ja, es gibt Ersatzschaufeln, Fisher Scientifi c Kat. Nr. 15388764. Dies ist die Standard-Ersatzschaufel, 30 ml. Es ist ebenfalls eine größere Ersatzschaufel mit 40 ml verfügbar, Fisher Scientifi c Kat. Nr. 15398764.
A. Min/Max sind die Temperaturablesungen in niedrigsten erreichten Bereich (Minimum) und im höchsten erzielten Bereich (Maximum), der erreicht wurde, seit der Speicher des Thermometers zuletzt gelöscht wurde; der Min/Max-Wert ist NICHT einstellbar. An bestimmten Geräten können Sie HW- und NW-Alarme einstellen, sodass das Gerät einen Alarm abgibt, wenn die Temperatur des von Ihnen gemessenen Objekts die voreingestellten Grenzwerte überschreitet. Einige Thermometer sind ebenfalls mit IN-/AUSAblesungen ausgestattet. Die IN- und AUS-Temperaturen beziehen sich auf verschiedene Sensoren, wobei IN den internen Sensor im Gerät und AUS den externen Fühler bezeichnet.
A. Flaschenfühler sind nützlich für den Einsatz in Kühlschränken, bei denen die Tür wahrscheinlich regelmäßig geöffnet wird. Der in der Flasche versiegelte Fühler zeigt die Temperatur des Produktes im Kühlschrank selbst und nicht die Lufttemperatur an, die schnell von der sich öffnenden Tür beeinträchtigt werden würde. Der Impfstofffühler nutzt ein ähnliches Konzept, hat aber ähnliche Maße wie die meisten Impfstofffl aschen. Dies hilft dabei, die Temperatur des gelagerten Impfstoffes genau zu bestimmen.
A. Die Flaschenfühler sind mit einer nicht giftigen Glycol-Lösung gefüllt, die von der US-amerikanischen Lebens-und Arzneimittelbehörde (FDA) als GRAS (generally recognised as safe - allgemein als sicher anerkannt) eingestuft wird.
A. Die verschiedenen "Ultra"-Produkte der Traceable™-Reihe sind an getesteten Kalibrierstellen mit einer Genauigkeit von 0,4 °C kalibriert Es sind weiterhin Geräte mit "extremer Genauigkeit" verfügbar. Diese werden mit einer Genauigkeit von ±0,05 innerhalb von 2 °C der getesteten Stellen kalibriert. Sie sind für die allgemein getesteten Punkte von 0 °C, 25 °C und 37 °C verfügbar. Darüber hinaus haben die präzisen Platin-Thermometer eine Genauigkeit von ±0,1 °C über den gesamten Temperaturbereich.
A. Falsche Messungen, eine schwache Anzeige oder keine Anzeige sind allesamt Anzeichen, dass die Batterien ausgetauscht werden müssen. In den meisten Fällen reicht ein einfaches Auswechseln der Batterien, damit das Gerät wieder normal funktioniert.
A. Wenn Sie die beiden Thermometer miteinander vergleichen, müssen Sie die Toleranzen der beiden Geräte addieren, um die Gesamtabweichung innerhalb der beiden Geräte zu ermitteln, die gemäß der Spezifi kation noch immer anerkannt werden kann. Wenn Sie zum Beispiel zwei gleiche Einheiten miteinander vergleichen, die eine Genauigkeit von ±0,1° C aufweisen, können die beiden Displays Temperaturen anzeigen, die bis zu 2 °C voneinander abweichen. Wenn die Temperaturen verschiedener Thermometer miteinander verglichen werden, ist darauf zu achten, dass die miteinander verglichenen Fühler gleichwertig sind
A. Fast alle Fisherbrand-Probenfläschchen werden aus Glas erster hydrolytischer Klasse hergestellt. Glas hydrolytischer Klasse ist sehr hart und weist auch bei hohen Temperaturschwankungen einen niedrigen Ausdehnungskoeffizienten auf. Es weist eine ausgezeichnete chemische Beständigkeit gegenüber sauren und neutralen Lösungen auf und ist sogar aufgrund des relativ geringen Alkaligehalts gegenüber alkalischen Lösungen beständig.
A. Alle Fisherbrand-Probenfläschchen, die ein CleanPack-Etikett auf der Vorderseite der Polypropylenverpackung aufweisen, wurden in einem zertifizierten Reinraum verpackt, nachdem sie durch einen Glühofen mit einer Temperatur von ungefähr 600 °C geleitet wurden. Das „CleanPack“-Etikett auf der Verpackung ist eine Garantie reiner, verunreinigungsfreier Probenfläschchen für eine korrekte Analyse. Darüber hinaus wird der Nachweis zur Manipulationssicherheit durch die mit Schrumpffolie eingeschweißte Unterseite der Polypropylenverpackung gegeben. Außerdem ermöglicht ihr Deckel jederzeit eine Wiederverschließbarkeit, während das Produkt in Gebrauch ist, um spätere Verunreinigungen der Probenfläschchen zu vermeiden.
A. Silanisierte Probenfläschchen werden verwendet, um die Adsorption von polaren Verbindungen auf der üblicherweise polaren Oberfläche des Glasbehälters zu verringern. Einige Verbindungen, wie z. B. Aminosäuren, Proteine oder Phenole, neigen dazu, mit den OH-Gruppen von Glas zu reagieren, selbst wenn hydrolytisches Glas erster Klasse (wie das in der Chromatographie üblich ist) verwendet wird. Durch den Prozess der Silanisierung wird die Glasoberfläche deaktiviert und somit werden mögliche Reaktionen zwischen polaren Verbindungen und dem Glas ausgeschlossen.
A. Die Wahl des richtigen Septums ist von der Anwendung abhängig. Fast alle Septa sind auf einer Seite mit PTFE beschichtet, das eine hohe chemische Beständigkeit aufweist und eine inerte Schutzschicht zwischen Probe und Trägermaterial des Septums bildet. Das Trägermaterial besitzt unterschiedliche physikalische und chemische Eigenschaften, wie beispielsweise Temperaturbeständigkeit, Wiederverschließbarkeit, Reinheit, Härte, Stärke usw. Bitte lesen Sie den Leitfaden auf Seite 13 dieser Broschüre zur Unterstützung beim Ermitteln der für Ihren Temperaturbereich und Ihre Anwendungen geeignetsten Septa.
A. Informationen dazu finden Sie in Tabelle 4: Informationen zur chemischen Kompatibilität von Probenfläschchen und Verschlussmaterial finden Sie auf den Seiten 16 bis 17 dieser Broschüre. Diese Tabelle dient lediglich zur Information. Viele Faktoren wirken sich auf die chemische Beständigkeit von Probenfläschchen und Verschlüssen aus, und wir möchten Sie darauf hinweisen, dass es in Ihrer Verantwortung liegt, Prüfungen unter eigenen Bedingungen vorzunehmen, um sicherzustellen, dass das verwendete Produkt vollständig kompatibel ist.
A. Die Härteprüfung von Kunststoffen wird üblicherweise anhand der Shore-Prüfung (Durometer) vorgenommen. Bei dieser Methode wird die Beständigkeit von Kunststoffen gegenüber Eindringen geprüft. Das Ergebnis ist ein empirischer Härtewert. Die Shore-Härte wird entweder unter Verwendung der Shore-Skalen „A“ oder „D“ gemessen. Dies ist die bevorzugte Messmethode für Gummi/ Elastomere und wird häufig auch für „weichere“ Kunststoffe wie Polyolefine, Fluorpolymere und Vinyl eingesetzt. Die Shore-Skala A wird für „weichere“ Gummiarten verwendet, während die Skala „D“ bei „härteren“ Gummiarten eingesetzt wird. Die meisten der Härtewerte von Septa werden durch die Shore-A-Messung abgedeckt, obwohl es einige Ausnahmen bei PTFE- und PE-Härten gibt, die unter Verwendung von Shore-D gemessen werden. Die aus dieser Prüfung gewonnenen Ergebnisse sind ein brauchbares Maß der relativen Beständigkeit gegenüber dem Durchdringen von unterschiedlichen Polymerklassen. Dies gibt Hinweise auf den Nadeltyp, der die Versiegelung durchstechen soll und ob Nadeln mit geringerer Stärke verwendet werden können.
A. Zertifizierungen werden immer wichtiger, um Prozesse reproduzierbarer zu gestalten und mögliche Fehlerquellen von Anfang an zu vermeiden. Höchste Qualität, Konsistenz und Qualitätskontrolle waren schon immer extrem wichtig und kommen in den drei Zertifizierungen „Spezifikations-zertifiziert“, „HPLC- und GC-zertifizierte Kits“ und „LC/MS und GC/MS-zertifizierte Kits“ zum Ausdruck. Weitere Informationen dazu finden Sie auf Seite 15 dieser Broschüre.
A. Derzeit sind auf dem Markt im Allgemeinen drei verschiedene Verschlusssysteme zum Versiegeln eines Autosampler-Probenfläschchens erhältlich:
Aus Sicht der Verdunstungsrate bietet ein Bördeldeckel die beste Versiegelung, gefolgt vom Schraubverschluss und dann vom Schnappverschluss. Aus Sicht der Handhabung sind jedoch Schraub- und Schnappverschlüsse praktischer, da kein Bördel- und Entbördelwerkzeug verwendet werden muss. Falls Sie eine praktische Handhabung und ebenso eine hohe Unversehrtheit der Probenfläschchen sowie die Reproduzierbarkeit eines gebördelten Probenfläschchens wünschen, so stellt das Probenfläschchen mit Schraubgewinde und Anschlagring die beste Alternative dar. Dieses Probenfläschchen mit Schraubgewinde bietet nicht nur die geringste Verdunstungsrate, sondern schließt auch ein Verkanten von Bördeldeckeln aus und sorgt für weniger Störungsfälle aufgrund von falsch behandelten Probenfläschchen bei der Autosampler-Herstellung.
Bei magnetischen Probenfläschchen-Transportsystemen in der hochmodernen Autosampler-Herstellung sind magnetisierbare Verschlüsse erforderlich. Diese Verschlussart ist für Bördel- und Schraubgewindeverschlüsse erhältlich.
A. Die Wiederverwendung oder das Auswaschen von Probenfläschchen stellt definitiv ein Risiko für die Unversehrtheit Ihrer Probe dar, da sich die Oberfläche des Probenfläschchens beim Reinigungsvorgang verändert (der Grad der Adsorption von kritischen Verbindungen erhöht sich) und das vollständige Entfernen von vorherigen Analyten nicht zu 100 % gewährleistet werden kann. Daher können Kreuzkontamination und/oder Geisterpeaks die Folge sein. Fachkräfte im Bereich der Chromatographie, die eine kompromisslose Unversehrtheit der Proben wünschen, sind am besten beraten, bei jeder Analyse stets neue Probenfläschchen und Septa zu verwenden.
A. Borosilikatglas verringert das Potenzial einer Verunreinigung durch Metalladdukte und sorgt so für zuverlässige Chromatogramme, selbst wenn das Produkt bereits über einen gewissen Zeitraum in Gebrauch ist.
A. Optima™ LC/MS-Produkte (Lösungsmittel, Mischungen, Zusatzstoffe und Reagenzien) wurden speziell entwickelt, um zu ermöglichen, dass empfindlichste Geräte auf Höchstleistungsniveau arbeiten. Gleichmäßige Basislinien und Hintergründe werden durch einen LC-Gradiententest mit PDA-Detektor gewährleistet. Mit diesen Tests wird außerdem dafür gesorgt, dass weder Verunreinigungen von positiven noch von negativen Ionen vorliegen. Da ein Vorhandensein von Metallanionen und Analyten die Spektren verkomplizieren, wurde unser Fertigungsprozess so entwickelt, dass die Verunreinigungen auf einem geringen Niveau gehalten werden. Für routinemäßigere analytische Anwendungen wird ein Produkt in LC/ MS-„Standard“-Qualität angeboten.
A. Verschiedene Anforderungen in der Chromatographie haben dazu geführt, dass wir nach Möglichkeiten gesucht haben, unsere Reinigungsverfahren zu verbessern und eine Reihe von Lösungsmitteln und Puffern zu entwickeln, die den Erfordernissen spezifischer Geräte entsprechen. Die Reinheitsgrade der Fisher Chemical-Lösungsmittel wurden entwickelt und getestet, um die Chromatographieleistung durch eine Auswahl an Reinheitsgraden zu optimieren und um diese sowohl auf den Geräte- als auch den Detektortyp abstimmen zu können.
| Chromatographieanwendung | Geräte- und Detektortyp | Reinheitsgrade der Fisher Chemical-Lösungsmittel |
| UHPLC-MS | UHPLC, gekoppelt mit Massendetektor | Optima UHPLC-MS |
| Hohe HPLC-MS | LC and UHPLC, gekoppelt mit Massendetektor | Optima LC/MS |
| HPLC-MS | LC, gekoppelt mit Massendetektor | LC-MS Qualität |
| UHPLC | UHPLC, gekoppelt mit UV-Detektor | UHPLC-Gradientenqualität |
| Hohe HPLC-Gradientenanalyse | LC-Gradient, ekoppelt mit UV-Detektor | Weiterentwickelte HPLC-Qualität |
| HPLC-Gradientenanalyse | LC-Gradient, gekoppelt mit UV-Detektor | HPLC-Gradientenqualität |
| HPLC (isokratisch) | LC, gekoppelt mit UV-Detektor | HPLC-Qualität |
Darüber hinaus bieten wir ein Sortiment an Lösungsmitteln für Spezialfachgebiete, um sonstige spezielle Chromatographietechniken zu unterstützen. Diese Lösungsmittel werden alle, soweit erforderlich, für HPLC ausgelegt und getestet:
A. Die Bestellnr. 10596814 von Fisher Scientific wird aus Sicherheitsgründen in HDPE-Flaschen abgefüllt. Mit der Verwendung einer HDPE-Flasche werden die Risiken eines Druckaufbaus durch Kohlenmonoxid vermieden, welches ein natürliches Abbauprodukt von Ameisensäure ist. Unsere Kunden müssen sich keine Gedanken über eine mögliche Verunreinigung durch Plastifiziermittel machen, da die HDPE-Flasche einer urheberrechtlich geschützten Oberflächenbehandlung unterzogen wird, um eine Schutzschicht zwischen der Flaschenoberfläche und der Ameisensäure zu erzeugen und somit eine Verunreinigung zu verhindern. Als Teil der guten Laborpraxis sollte dieses Produkt bei 4 °C aufbewahrt werden, um diesen natürlichen Abbauprozess zu verlangsamen.
Ameisensäure in Optima™ LC/MS-Qualität ist auch in 0,5 ml-, 1 ml- und 2 ml-Glasampullen (Borosilikat) unter jeweils den Fisher Scientific-Bestellnummern 10780320, 10473038 und 10063427 erhältlich. Hinweis: Diese Ampullen sind für ein leichtes Öffnen vorgestanzt.
A. Nein, eine vorübergehende Aufbewahrung unter Umgebungsbedingungen beeinträchtigt die Reagenz nicht. Für eine langfristige Aufbewahrung empfehlen wir jedoch, das Produkt unter kühlen Temperaturen bei 4 °C aufzubewahren, um die Produktunversehrtheit länger aufrechtzuerhalten.
A. Der Hauptunterschied zwischen Borosilikatglas und herkömmlichem Kalknatronglas besteht darin, dass bei der Herstellung von Borosilikatglas Natrium und Kalk durch Bortrioxid ersetzt werden. Borosilikatglas besitzt eine höhere Hitzebeständigkeit und dehnt sich weniger stark aus als Kalknatronglas, d. h. es kann bei extrem hohen und niedrigen Temperaturen eingesetzt werden. Diese Eigenschaften machen Borosilikatglas zu einem sehr beliebten Laborglasprodukt
A. Glas gilt in der Regel als sicher für das Autoklavieren. Beim Autoklavieren von Glasbehältern müssen die Verschlusskappen gelöst sein. Beim Autoklavieren mit festgeschraubten Kappen können Druckunterschiede entstehen, die zum Bruch führen. Autoklavieren Sie keine Gläser, die geätzt, gesprungen, abgesplittert oder zerkratzt sind. Solche Defekte reduzieren die thermische Widerstandsfähigkeit und erhöhen das Bruchrisiko.
A. Während Erlenmeyerkolben und -becher mit entsprechenden Volumenmarkierungen versehen sind, besteht dennoch eine Unsicherheit von +/-5 % bezüglich des tatsächlichen Standes der Füllstandslinie. Es gibt nur fünf volumetrische Messgeräte, die als präzise und genau für Analyseaufgaben anerkannt sind. Dies sind Messkolben, Messzylinder, Büretten, Messpipetten und Vollpipetten, die entsprechend ihrer Eigenschaften entweder als Klasse A oder als Klasse B qualifiziert sind.
A. Volumetrische Laborglasgefäße wie z. B. Messkolben, Messzylinder, Büretten, Messpipetten und Vollpipetten werden gemäß der Standards der American Society for Testing and Materials (ASTM) hergestellt und kalibriert (die ASTM-Kriterien haben Vorrang vor den Vorgaben anderer Normenorganisationen wie etwa BSI und DIN). Sie sind in zwei verschiedenen Qualitäten verfügbar, Klasse A und Klasse B. Die Toleranzen, nach denen die Gläser ausgezeichnet werden, werden durch die ASTM-Standards definiert. Die strengsten Toleranzen treffen auf die Klasse A zu, während Klasse B im Allgemeinen etwa den doppelten Toleranzbereich von Klasse A zulässt.
A. Die Fisherbrand-Volumenpipetten aus Glas wurden mit der Klasse AS ausgezeichnet, die vor kurzem die Klasse A ersetzte. Klasse AS ist der europäische Standard und schreibt die gleichen strengen Genauigkeitskriterien und Toleranzen entsprechend der relevanten ISO- und DIN-Normen vor wie Klasse A. Die serologischen Pipetten der Klasse AS haben zudem eine raschere Abgabegeschwindigkeit als Pipetten der Klasse A (das „S“ steht für das deutsche Wort „Schnell“). Aufgrund der schnelleren Abgabegeschwindigkeit muss beim Füllen und Abgeben des erforderlichen Volumens eine Wartezeit von nur fünf Sekunden eingehalten werden. Dadurch kann sich der Meniskus stabilisieren, was zur optimalen Genauigkeit beiträgt.
A. Die Ultraschallreinigung ist eine empfohlene Methode zur gründlichen Reinigung von Glasprodukten. Mit Heizung ausgestattete Ultraschallreinigungsgeräte sind am besten. Bei Verwendung eines Ultraschallreinigungsgerätes mit einem milden Reinigungsmittel werden in der Regel die meisten Rückstände vom Glas entfernt. Wenn Sie zur Reinigung von Glasgefäßen einen Automaten benutzen, sollten Sie immer darauf achten, dass das Glas sicher eingestellt wird und beim Ein- und Ausräumen des Automaten besonders vorsichtig vorgehen, da es hier oft zu Absplitterungen oder Glasbruch kommt.
A. Braunglas dient in Labors zum Schutz von UV-empfindlichen Chemikalien und Substanzen. Braunglas hält UV-Strahlung im Bereich von 350 bis 200 nm zurück. Zudem blockiert Braunglas auch den UVC-Bereich zwischen 200 und 280 nm, in dem Mikroorganismen abgetötet werden. Jedoch wird durch Braunglas nicht das gesamte UV-Spektrum blockiert.
A. Die Haltbarkeit oder Nutzbarkeit von Glasbehältern ist nicht begrenzt. Jedoch ist es wichtig, dass Gläser regelmäßig auf mögliche Beschädigungen geprüft werden, die die Sicherheit bzw. Genauigkeit beeinträchtigen können. Wenn ein Glas deutliche Beschädigungen aufweist, muss es entsorgt und ersetzt werden.
A. In der Regel können Glasgefäße Temperaturen bis 500 °C standhalten. Sobald die Temperatur jedoch 150 °C übersteigt, muss besonders vorsichtig vorgegangen und darauf geachtet werden, dass das Erhitzen und Abkühlen langsam und gleichmäßig erfolgen. Bei Verwendung von Heizplatten muss die Aufsatzplatte größer sein als der zu erhitzende Gefäßboden. Und stellen Sie keine kalten Glasgefäße auf eine bereits vorgeheizte Heizplatte. Erwärmen Sie das Gefäß allmählich bei Umgebungstemperatur beginnend. Wenn ein Bunsenbrenner verwendet wird, stellen Sie ihn so ein, dass die Flamme breit und schwach ist, sodass das Glas langsam und gleichmäßiger erhitzt wird. Verwenden Sie zusätzlich ein Drahtnetz mit Keramik in der Mitte, damit die Flamme gut verteilt wird.
A. Es gibt keine festgelegten Richtlinien zur Rekalibrierung von Glasgefäßen, da dies von der Art und Weise abhängt, wie die Produkte gereinigt, gehandhabt und gelagert werden. Normalerweise müssen volumetrische Glasgefäße nur nach langem oder intensivem Gebrauch rekalibriert werden, da dadurch die ursprüngliche Genauigkeit herabgesetzt werden kann. So sollte beispielsweise eine Rekalibrierung in Betracht gezogen werden, wenn:
A. Die beste Garantie für genaue Volumen besteht darin, sicherzustellen, dass das Glas sauber ist. Bei Büretten und Pipetten ist die Sauberkeit daran zu erkennen, dass auf der Innenfläche des Glases keine „Wasserperlen“ haften bleiben. Wenn das Produkt sauber ist, bildet die Lösung einen dünnen, durchgehenden Film auf der Innenfläche des Glases. Zum Reinigen von Pipetten und volumetrischen Glasgefäßen genügt meist ein kurzes Einweichen in warmer Reinigungslösung. Vermeiden Sie ein zu langes Einweichen der Glasgefäße, da ein längerer Kontakt mit der Reinigungslösung zur Bildung von rauen Stellen an der Glas-/Luft-Übergangsstelle führen kann, wodurch das Produkt unbrauchbar wird. Nach dem kurzen (2 bis 3 Minuten langen) Einweichen muss das Glas gründlich mit Leitungswasser und anschließend drei- bis viermal mit destilliertem oder entionisiertem Wasser gespült werden. Trocknen Sie die Glasoberflächen nicht mit Handtüchern, lassen Sie die Gläser einfach vor Staub geschützt trocknen. Es ist nicht notwendig, Gläser im Trockenautomat zu trocknen. Wenn Sie jedoch einen haben, empfiehlt sich seine Verwendung. So trocknet das Glas schneller und wird gleichzeitig während des Trocknens vor Staub geschützt.
A. Für Fisherbrand-Flaschen wurde kein Nenndruck festgelegt, daher sollte vorsichtig vorgegangen werden, wenn Gläser bei Druckanwendungen eingesetzt werden. Fisher Scientific kann keine Garantie für die Bruchsicherheit von Laborgläsern übernehmen, wenn diese unter Vakuum oder Druck eingesetzt werden.
A. Nur Produkte aus Polypropylen, PTFE, PC und PMP (TPX) können autoklaviert werden (ein Autoklavierungszyklus besteht aus einem 20-Minuten-Zyklus bei 121 °C und 1 bar (15 psi)). Achten Sie beim Autoklavieren von Flaschen stets darauf, dass die Verschlusskappen gelöst sind. Beim Autoklavieren mit festgeschraubten Kappen kann sich das Gefäß zusammenziehen oder verformen. Setzen Sie volumetrische Kunststoffgefäße wie z. B. Messzylinder, Kolben usw. keinen Temperaturen über 60 °C aus, da hohe Temperaturen die Messgenauigkeit beeinträchtigen können.
A. Sowohl LDPE als auch HDPE besitzen eine Versprödungstemperatur von -100 °C und können daher zum Einfrieren von Proben benutzt werden, deren Volumen zu groß für Standard-Cryovials sind. Dabei muss darauf geachtet werden, dass im Behälter genug Raum frei bleibt, damit sich die Probe ausdehnen kann. Zu empfehlen sind u. a. Fisher Scientific Art.- Nr. 11735383, 11775243 und 11957934.
A. Für Anwendungen, die eine gute optische Klarheit erfordern, sind Polymere wie Polystyrol, PET, PMP oder Polycarbonat vorzuziehen. Andere Polymere wie Polypropylen und Polyethylen sind durchscheinend und manchmal auch undurchsichtig und daher nicht ideal für diese Anforderung.
A. Informationen zur Kompatibilität einer spezifischen Chemikalie mit einem bestimmten Polymer entnehmen Sie bitte der „Übersicht zur chemischen Verträglichkeit“ auf Seite 14 und 15.
A. Ein leicht bzw. nicht alkalisches Reinigungsmittel eignet sich zur Reinigung der meisten Kunststoffartikel. Beachten Sie jedoch, dass Polystyrol- und Polycarbonatprodukte anfällig gegen alkalische Substanzen sind und daher ein Neutralreiniger empfohlen wird. Vermeiden Sie unbedingt den Einsatz von Scheuermitteln oder -schwämmen, die die Oberflächen zerkratzen oder angreifen können.
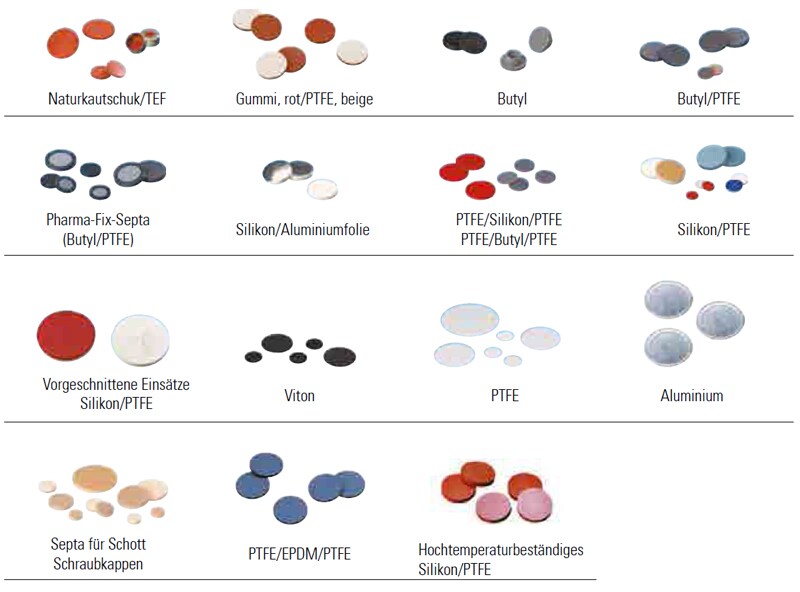
A. Die richtige Wahl der Flaschen- bzw. Fläschchensepta hängt von der jeweiligen Anwendung ab. Die meisten Septa sind auf einer Seite mit PTFE laminiert, das eine hohe Chemikalienbeständigkeit aufweist und eine inerte Barriere zwischen Probe und darunter liegendem Trägermaterial bildet. Die Trägermaterialien haben unterschiedliche physikalische und chemische Eigenschaften, z. B. im Hinblick auf Temperaturbeständigkeit, Wiederverschließbarkeit, Reinheit, Härte, Dicke usw. Auf der gegenüber liegenden Seite finden Sie einen Leitfaden zur Wahl der besten Septa für Ihre Anwendung.
Septa
Besondere Bedingungen im Zusammenhang mit Ihrer individuellen Anwendung müssen bei der Wahl der besten Septummaterialien berücksichtigt werden, wie im folgenden Diagramm veranschaulicht.

Auf den folgenden Abbildungen sehen Sie die häufigsten Materialkombinationen für Septa, die auf dem Markt verfügbar sind. Bitte beachten Sie jedoch, dass die Farbe nicht unbedingt Aufschluss über das tatsächliche Einsatzmaterial gibt.
Problem |
Vorschläge |
Bei Anlegen der Betriebsspannung treten an den Elektroden keine Blasen auf |
|
Geschmolzene Agarose leckt beim Gießen |
|
Probenvertiefung ist verformt |
|
Proben lecken beim Laden unter das Gel |
|
Proben laufen nicht gerade |
|
„Smiling-Effekt“ an einem Rand des Gels |
|
Der Farbstoff „Bromphenol Blue“ wird gelb |
|
Doppelbandiges Muster |
|
Banden „mit Schwanz“ (übermäßige Fluoreszenz oberhalb der Bande) |
|
Schlechte Bandenauflösung |
|
Gel schmilzt oder erweicht in der Nähe von Probenvertiefungen |
|
Problem |
Ursache |
Vorschläge |
Schlechter Proteintransfer |
Übertragungsgerät falsch zusammengesetzt und Proteine bewegen sich in die falsche Richtung |
|
Das Western-Erkennungssystem funktioniert nicht oder ist nicht empfindlich genug |
|
|
Übertragungszeit zu kurz |
|
|
Leistungseinstellung zu niedrig |
|
|
Falsches Verhältnis von Ladung zur Masse für native Übertragungen |
|
|
Defekte oder ungeeignete Stromversorgung verwendet |
|
|
Überschüssiges Methanol beschränkt den Transfer |
|
|
Präzipitation des Proteins in das Gel |
Präzipitation des Proteins in das Gel |
|
Wirbel oder fehlende Banden; diffuse Übertragungen |
Schlechter Gel-Membran-Kontakt. Luftblasen oder überschüssiger Puffer verbleiben zwischen Membran und Gel |
|
Membran ist nicht vollständig nass oder ist ausgetrocknet |
|
|
Problem mit der Gelelektrophorese |
|
|
Gel-Kassettenmuster wurde auf den Blot übertragen |
Kontaminierte Faserpads |
|
Schlechte Bindung an Membran - Nitrocellulose |
Überschüssiges Methanol beschränkt den Transfer |
|
Proteine können durch Nitrocellulose übertragen werden |
|
|
Proteine <15 kDa haben eine reduzierte Bindung an 0,45 µm Nitrocellulose oder können während der Assays von der Membran abgewaschen werden |
|
|
SDS in Transferpuffer reduziert die Bindungseffizienz |
|
|
Membran ist nicht vollständig nass |
|
|
Schlechte Bindung an Membran - PVDF |
Membran ist nicht vollständig nass |
|
Proteine könnten durch die Membran übertragen werden |
|
|
Membran könnte während der Handhabung getrocknet sein |
|
|
SDS in Transferpuffer reduziert die Bindungseffizienz |
|
|
Strom |
Strom zu hoch |
|
Immunspezifische Erkennung |
Insgesamt hoher Hintergrund |
|
Gesamter Proteinnachweis |
Gesamter Proteinnachweis |
|
Problem |
Ursache |
Vorschläge |
Keine Anzeige/Leuchten |
Kein Wechselstrom |
|
Kabel der Stromquelle nicht angeschlossen |
|
|
Sicherung ist durchgebrannt |
|
|
Sicherung wiederholt defekt |
Hardwarefehler |
|
Betrieb stoppt |
Elektrophorese-Kabel sind nicht an die Stromversorgung oder an die Elektrophorese-Einheit(en) angeschlossen. Im Elektrophorese-Tank ist ein Stromkreis unterbrochen |
|
Hoher Widerstand aufgrund von Klebebandablagerungen auf einem vorgefertigten Gel; falsche Pufferkonzentration oder falsches Volumen im Elektrophorese-Tank |
|
|
Er1 Fehlermeldung |
Strom übersteigt den maximalen Ausgabewert für die Stromversorgung (> 400 mA) |
|
Er2 Fehlermeldung |
Spannung übersteigt den maximalen Ausgabewert für die Stromversorgung (>300 mA) |
|
Er3 Fehlermeldung |
Thermische Begrenzung der Stromversorgung erreicht (Ausgangsspannung <10 V) |
|
nld-Meldung |
Keine Ladung erkannt |
|
AL1-Alarmmeldung |
Leistung übersteigt die maximale Leistung (60 W) |
|
| Problem | Ursache | Lösungsvorschläge |
| Messgerät lässt sich nicht kalibrieren | Messgerät |
|
| Puffer |
|
|
| Elektrode |
|
|
| Technik |
|
|
| Das Messgerät zeigt fehlerhafte oder instabile Werte an | Elektrode |
|
| Technik |
|
|
| Elektroden halten üblicherweise weniger als 6 Monate, wenn sie mit Tris-Puffer/Proteinproben verwendet werden. | Elektrode |
|
| Die neue Elektrode wurde mit weißen Kristallen geliefert | Elektrode |
|
| Elektrodenfühler/Körper hat einen Riss und leckt | Elektrode |
|
| Instrument liest falsche Temperatur ab | Temperaturausgleichssonde (ATC) |
|
| Andere potentielle Probleme | Temperatur |
|
| Bedienertechnik |
|
|
| Probentyp |
|
| Problem | Ursache | Lösungsvorschläge |
| Leitfähigkeit | Messgerät |
|
| Leitfähigkeitsmesszelle |
|
|
| Technik |
|
| Problem | Ursache | Lösungsvorschläge |
| ISE Display zeigt an “- - -“ | Es wurde keine Zweipunktkalibrierung durchgeführt. |
|
| Leitfähigkeit - kann nicht angepasst oder nicht kalibriert werden | Leitfähigkeit Kalibrierungsstandards/ Einstellungen |
|
| Leitfähigkeit - Zweiter Kalibrierungspunkt ersetzt den ersten. | Einstellungen |
|
| TDS - Standard stimmt nicht | Einstellungen |
|
| “OR” oder “UR” Fehlermeldung | Messgerät |
|
| Passwort vergessen | Messgerät |
|
| Kat. Nr. | Kanäle | Traceable™ Zertifikat mitgeliefert |
Genauigkeit | Maximale Zeit | Auflösung | Batterie | Uhr | Speicher | Eigenschaften |
| 11745863 | 4 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15338754 | Ja | Ja | 4-Kanal-Rückwärtszähler/ Vorwärtszähler |
| 11784426 | 4 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15338754 | Ja | Ja | Personalisieren Sie Ihren Timer |
| 11725863 | 3 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15348754 | Ja | Ja | Durchgehender Alarm |
| 11705873 | 3 | Ja | 0,01% | 20 Stunden | 1 Sekunde | 15348754 | Ja | Ja | Dreifache Anzeige |
| 11597453 | 3 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15338754 | Ja | Ja | Dreifache Anzeige |
| 11749795 | 2 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15348754 | Nein | Ja | Visuelle und Audioalarme |
| 11745759 | 2 | Ja | 0,01% | 24 Stunden | 1 Sekunde | 15348754 | Ja | Ja | Einstellbare Anzeige |
| 11755863 | 2 | Ja | 0,01% | 24 Stunden | 1 Sekunde | 15338754 | Ja | Ja | 2-Kanal-Rückwärtszähler/ Vorwärtszähler |
| 12695296 | 2 | Ja | 0,01% | 24 Stunden | 1 Sekunde | 15338754 | Ja | Ja | Ultra-kompakt |
| 11507493 | 2 | Ja | 0,01% | 20 Stunden | 1 Sekunde | 15338754 | Ja | Ja | Zweizeilige Anzeige |
| 11739795 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15348754 | Nein | Ja | Visuelle und Audioalarme |
| 15204016 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15348754 | Nr. | Ja | Extra große Ziffernanzeige |
| 11765863 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15348754 | Nein | Ja | Jumbo-Ziffern |
| 11795863 | 1 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15338754 | Ja | Ja | Zifferntasten |
| 11512793 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15338754 | Nein | Nein | Zifferntasten |
| 11789795 | 1 | Ja | 0,01% | 24 Stunden | 1 Sekunde | 15338754 | Ja | Ja | Innovatives Design |
| 11775873 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15348754 | Nein | Ja | Sofortiger Speicherabruf |
| 11799795 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15348754 | Nein | Ja | Automatischer Speicher |
| 11715873 | 1 | Ja | 0,01% | 20 Stunden | 1 Sekunde | 15348754 | Nein | Nein | Leichter Betrieb mit drei Tasten |
| 11745873 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15338754 | Nein | Ja | Einfache Hundhabung |
| 11765873 | 1 | Ja | 0,01% | 100 Stunden | 1 Sekunde | 15338754 | Nein | Ja | Kann überall angeklemmt werden |
| 11729805 | 1 | Ja | 0,01% | 100 Minuten | 1 Sekunde | 15338754 | Nein | Ja | Wasserbeständig |
für further infürmation refer bis 'Focus on Traceable™ Products' brochure page 8
| Kat. Nr. | Zeitmessung Leistung |
Traceable™ Zertifikat mitgeliefert |
Genauigkeit | Auflösung | Zeitmessungsfunktionen (siehe unten) |
Eigenschaften |
| 15233966 | 24 Stunden | Ja | 0,0035% | 1/100 Sekunde | A, B, C, D | Große Ziffern |
| 11755833 | 24 Stunden | Ja | 0,0010% | 1/100 Sekunde | A, B, C, D | Wasserbeständig |
| 11765833 | 24 Stunden | Ja | 0,01% | 1/100 Sekunde | A, B, C, D | Wegwerfbar |
| 11522803 | 10 Stunden | Ja | 0,001% | 1/100 Sekunde | A, B, C, D | 60 Speicherstellen |
für further infürmation refer bis 'Focus on Traceable™ Products' brochure page 15
| Kat. Nr. | Traceable™ Zertifikat mitgeliefert |
Bereich | Auflösung | Genauigkeit | Fühlerlänge | Länge Kabel | Wasserdicht | Batterie | Alarme | Anzeige MIN/MAX |
| 11715853 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,01 ° | ±3°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 11725853 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,01 ° | ±0,3°C | 63 mm | 3 m | Fühler/Kabel | 15358754 | Ja | Ja |
| 11735853 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,01 ° | ±0,3 ° | 19 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 11705853 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,1 ° | ±0,5°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 11709755 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,1°C | ±10,5°C | 19 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 11715863 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,1°C | ±0,5°C | 33 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 11873460 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 1 ° | ±1°C | 63 mm | 3 m | Fühler/Kabel | 15358754 | Ja | Ja |
| 11799735 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 1 ° | ±1°C | 19 mm | 3 m | Fühler/Kabel | 15358754 | Ja | Ja |
| 11749745 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 1 ° | ±1°C | 33 mm | 3 m | Fühler/Kabel | 15358754 | Ja | Ja |
| 15274016 | Ja | -30 bis 70 °C (-22 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | n. z. | Fühler/Kabel | 15348754 | Ja | Ja |
| 15284016 | Ja | -30 bis 70 °C (-22 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | n. z. | Fühler/Kabel | 15348754 | Ja | Ja |
| 11709745 | Ja | -30 bis 70 °C (-22 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | n. z. | Ja | 15338754 | Nein | Ja |
| 11719745 | Ja | -30 bis 70 °C (-22 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | n. z. | Ja | 15338754 | Nein | Ja |
| 11729745 | Ja | -30 bis 70 °C (-22 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | n. z. | Ja | 15338754 | Nein | Ja |
| 11739745 | Ja | -30 bis 70 °C (-22 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | n. z. | Ja | 15338754 | Nein | Ja |
| 1178543 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 1 ° | ±1°C | 19 mm | 3 m | Fühler/Kabel | 15338754 | Nein | Ja |
| 11765853 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 1 ° | ±1°C | 63 mm | 3 m | Fühler/Kabel | 15338754 | Nein | Ja |
| 12641395 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 1 ° | ±1°C | 33 mm | 3 m | Fühler/Kabel | 15338754 | Nein | Ja |
| 11705863 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,1 ° | ±1°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 13577070 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,01 ° | ±0,1°C ± 2% | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 13567070 | Ja | -50 bis 70 °C (-58 bis 158 °F) | 0,01 ° | ±0,025%°C | 33 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 13507080 | Ja | -50 bis 70 °C (-148 bis 158 °F) | 0,01 ° | ±0,25°C | 33 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
für further infürmation refer bis Focus on Traceable™ Products brochure pages 19
| Kat. Nr. | Traceable™ Zertifikat mitgeliefert |
Beireich | Auflösung | Genauigkeit | Fühlerlänge | Wasserdicht | Batterie | Alarme | Anzeige MIN/MAX |
| 15234016 | Ja | -200 bis 500°C (-328 bis 982 °F) |
0,0001 ° | ±0,05°C | 160 mm | Nein | 15318754 | Nein | Ja |
| 15244016 | Ja | -100 bis 200°C (-148 bis 392 °F) |
0,0001 ° | ±0,05°C | 25 mm | Nein | 15318754 | Nein | Ja |
| 11705843 | Ja | -50 bis 150°C (-58 bis 302 °F) |
0,0001 ° | ±0,05°C | 229 mm | Fühler only | 15318754 | Nein | Ja |
| 13597070 | Ja | -100 bis 199°C (-148 bis 199 °F) |
0,1 ° | ±0,01°C | 229 mm | Fühler only | 15348754 | Nein | Ja |
| 13577070 | Ja | -50 bis 70°C (-58 bis 158 °F) |
0,01 ° | ±0,1°C | 63 mm | Fühler/câble | 15348754 | Ja | Ja |
| 13567070 | Ja | -50 bis 70°C (-58 bis 158 °F) |
0,01 ° | ±0,25°C | 33 mm | Fühler/câble | 15348754 | Ja | Ja |
| 13507080 | Ja | -100 bis 70°C (-148 bis 158 °F) |
0,01 ° | ±0,25°C | 33 mm | Fühler/câble | 15348754 | Ja | Ja |
| 11729765 | Ja | -50 bis 400°C (-58 bis 752 °F) |
0,01 ° | ±0,1 ± 0,2°C | 160 mm | Fühler only | 15318754 | Nein | Nein |
| 11739765 | Ja | -99 bis 200°C (-146 bis 392 °F) |
0,1 ° | ±2°C | 76 mm | Fühler only | 15318754 | Nein | Nein |
| 11799725 | Ja | -50 bis 300°C (-58 bis 572 °F) |
0,1 ° | ±1°C | 190 mm | Fühler only | 15338754 | Ja | Ja |
| 11749725 | Ja | -50 bis 150°C (-58 bis 302 °F) |
0,1 ° | ±1°C | 178 mm | Fühler only | 15338754 | Nein | Nein |
| 11789725 | Ja | -50 bis 260°C (-58 bis 500 °F) |
0,1 ° | ±1°C | 197 mm | Fühler only | 15348754 | Ja | Ja |
| 11715843 | Ja | -50 bis 300°C (-58 bis 572 °F) |
0,1 ° | ±1°C | 114 mm | Ja | 15328754 | Nein | Ja |
| 11785853 | Ja | -50 bis 300°C (-58 bis 572 °F) |
0,1 ° | ±1°C | 203 mm | Ja | 15338754 | Nein | Ja |
| 11799715 | Ja | -50 bis 300°C (-58 bis 572 °F) |
0,1 ° | ±0,4°C at tested points |
203 mm | Ja | 15338754 | Nein | Ja |
| 11799705 | Ja | -50 bis 150°C (-58 bis 302 °F) |
0,1 ° | ±1°C | 203 mm | Fühler only | 15338754 | Nein | Nein |
| 11719715 | Ja | -50 bis 150°C (-58 bis 302 °F) |
0,1 ° | ±0,2°C | 203 mm | Fühler only | 15338754 | Nein | Nein |
| 11729715 | Ja | -50 bis 300°C (-58 bis 572 °F) |
0,1 ° | ±1°C | 289 mm | Fühler only | 15338754 | Nein | Nein |
| 11739715 | Ja | -50 bis 300°C (-58 bis 572 °F) |
0,1 ° | ±0,5°C | 289 mm | Fühler only | 15338754 | Nein | Nein |
für further infürmation refer bis ′Focus on Traceable™ Products′ brochure pages 22 bis 24
| Kat. Nr. | Traceable™ Zertifikat mitgeliefert |
Bereich | Auflösung | Genauigkeit | Fühlerlänge | Wasserdicht | Batterie | Alarme | Anzeige MIN/MAX |
| 15283996 | Ja | -50 bis 150°C (-58 bis 302 °F) |
0,1 ° | ±1 °C | 127 mm | Gesamtes Gerät | 15338754 | Nein | Ja |
| 15293996 | Ja | -50 bis 150°C (-58 bis 302 °F) |
0,1 ° | ±1 °C | n. z. | Gesamtes Gerät | 15348754 | Nein | Ja |
| 11775853 | Ja | Infrarotsensor-55 bis 250 °C (-67 bis 482 °F) Einstich-Edelstahl-Sensor -55 bis 330 °C (-67 bis 626 °F) |
0,20 °C (0,5 °F) zwischen -10 und 200; ansonsten 1 ° 0,2 °C (0,5 °F) zwischen -10 und 200; ansonsten 1 ° |
±0,6 °C zwischen -5 und 65 °C ±0,5 °C |
n. z. 152 mm |
n. z. Nur Fühler |
15318754 | Nein | Ja |
| 11779775 | Ja | -200 bis 1,333°C (-328 bis 2,431 °F) |
0,1 ° | ±0,1 °C | 1.2m | Nur Kabel | 15358754 | Ja | Ja |
| 11709795 | Ja | -28 bis 38°C (-20 bis 100 °F) |
n. z. | ±1 °C | n. z. | n. z. | 15358754 | Nein | Nein |
| 11719795 | Ja | -28 bis 38°C (-20 bis 100 °F) |
n. z. | ±1 °C | n. z. | n. z. | 15358754 | Nein | Nein |
| 11759755 | Ja | -50 bis 70°C (-58 bis 158 °F) |
0,2 ° | ±1 °C | 3 m | Fühler/câble | 15348754 | Nein | Ja |
| 11749765 | Ja | -200 bis 1,370°C (-328 bis 2,498 °F) |
0,1 ° und 1% | ±1 °C | 6 mm | Nur Kabel | 15348754 | Ja | Ja |
| 11789765 | Ja | -200 bis 1,300°C (-328 bis 2,372 °F) |
0,1 ° und 1% | ±0,3% + +1 °C | 6 mm | Nur Kabel | 15348754 | Nein | Ja |
| 11729785 | Ja | -60 bis 500°C (-76 bis 932 °F) |
0,1 ° | ±2 °C oder 2% | n. z. | n. z. | 15338754 | Nein | Nein |
| 11779785 | Ja | -50 bis 1,000°C (-58 bis 1,832 °F) |
0,1 ° | ±1.5% ±2 °C | n. z. | n. z. | 15348754 | Nein | Nein |
| 11709785 | Ja | -33 bis 220°C (-27 bis 428 °F) |
0,1 ° | ±1 °C ± 2% | n. z. | n. z. | 15348754 | Nein | Nein |
für further infürmation refer bis ′Focus on Traceable™ Products′ brochure pages 25 bis 28
| Kat. Nr. | Traceable™ Zertifikat mitgeliefert |
Bereich | Auflösung | Genauigkeit | Fühlerlänge | Länge Kabel | Wasserdicht | Batterie | Alarme | Anzeige MIN/MAX |
| 15294016 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15204026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15214026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 19 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15224026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 19 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15234026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15244026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 159 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15388754 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 159 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15264026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15274026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15284026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 19 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15294026 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 19 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15204036 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 63 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15214036 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 159 mm | 3 m | Fühler/Kabel | 15348754 | Ja | Ja |
| 15224036 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,01 | ±0,25°C | 159 mm | 3 m | Ja | 15348754 | Ja | Ja |
| 15398754 | Ja | -50 bis 70°C (-58 bis 158 °F) | 0,1 | ±0,2°C zwischen 0 und 10°C, ±1°C anderswo | n. z. | n. z. | Ja | CR2016 3V LithiumKnopfzelle | Ja | Ja |
| 15318764 | Ja | -29 bis 72°C (-20 bis 162 °F) | 0,1 | ±0,2°C zwischen 0 und 30°C, ±5°C anderswo | n. z. | n. z. | Ja | CR2450 3V LithiumKnopfzelle | Ja | Ja |
| 15238764 | Ja | -200 bis 72°C (-328 bis 162 °F) | 0,1 | ±2°C zwischen 0 und 30°C, ±2°C anderswo | 109mm | 0,5m | Ja | CR2473 3V LithiumKnopfzelle | Ja | Ja |
| 13557070 | Ja | -30 bis 70°C (-22 bis 158 °F) | 0,1 | ±0,6°C | 63 mm | 2m | Fühler/Kabel | 15358754 | Ja | Ja |
| 13587070 | Ja | -30 bis 70°C (-22 bis 158 °F) | 0,1 | ±0,6°C | 63 mm | 2m | Fühler/Kabel | 15348754 | Ja | Ja |
für further infürmation refer bis Focus on Traceable™ Products brochure pages 29 bis 30
| Kat. Nr. | Traceable™ Zertifikat mitgeliefert |
Relativer Feuchtigkeitsbereich | Auflösung | Genauigkeit | Temperaturbereich | Auflösung | Genauigkeit | Batterie | Eigenschaften |
| 15214016 | Ja | 0 bis 90% | 0,1% | ±0,5% RF |
0 bis 50°C | 0,1°C | ±1°C | 15318754 | Daten-Logger mit Speicherkarte |
| 11765843 | Ja | 25% bis 90% | 1% | ±2% RF | 0 bis 50°C | 1°C | ±1°C | 15348754 | Duale Min/Max-Speicher |
| 11724196 | Ja | 1 bis 99% | 0,1% | ±4% RF | -40 bis 70°C | 0,1°C | ±1°C | 15348754 | Taupunkt und Feuchtmonitor |
| 11725843 | Ja | 20 bis 90% | 1% | 5% RF | 0 bis 50°C | 0,1°C | ±1°C | 15348754 | Anzeige der Zeit, Temp. und Feuchtigkeit |
| 15264006 | Ja | 1 bis 99% | 1% | ±3% RF | -10 bis 60°C | 1°C | ±1°C | 15348754 | RF-Alarm und Ablesung des Taupunkts |
| 11755843 | Ja | 5 bis 95% | 0,01% | ±1.5% RF | -40 bis 104°C | 0,01°C | ±0,4°C | 15318754 | Reaktionszeit von 10 Sekunden |
| 11745843 | Ja | 10 bis 95% | 0,01% | ±1.5% RF | -40 bis 104°C | 0,01°C | ±0,4°C | 15318754 | Liest ebenfalls den Taupunkt ab |
| 11597443 | Ja | 10 bis 95% | 0,1% | ±2% RF | -18 bis 93°C | 0,1°C | ±1°C | 15318754 | Computerausgang |
| 11536973 | Ja | 10 bis 95% | 0,1% | ±2% RF | -50 bis 70°C | 1°C | ±1°C | 15348754 | Jumbo-Ziffern |
| 11714196 | Ja | 20 bis 99% | 1% | ±5% RF | -50 bis 70°C | 0,1°C | ±1°C | 15348754 | Fernablese-Feuchtigkeitssensor |
| 11739835 | Ja | 10 bis 95% | 0,1% | ±3% RF Mittelbereich, ±5% RF anderswo | -20 bis 60°C für T1 -200 bis 1,333°C für T2 | 0,1° für T1 0,1°C für T2 von -200 bis 999.9°C, anderswo 1°C | ±1 °C für T1 ±2% der Ablesung plus 1,8 °C für T2 | 15348754 | Ausdruck der Ablesungen |
| 11782146 | Ja | 0 bis 100% | 10% | ±5% RF | n. z. | n. z. | n. z. | n. z. | Feuchtigkeitskarte |
für further infürmation refer bis Focus on Traceable™ Products brochure page 32
| Lösungsmittelklasse und Produktcode | ||||||||
| Lösungsmittel | Menge | Verpackung | HPLC-Qualität | HPLC-Gradien-tenqualität grade |
Advanced HPLC grade |
Erweiterte HPLC-Qualität |
LC/MS | Optima LC/MS |
| Acetonitril GHS: Entz. Flüüss.2, Akut Tox.4, Augenreiz.2 |
500 ml 1 l 1 l 2,5 l 2,5 l 4 l 5 l |
Glasflasche Glasflasche Kunststoffummantelte Glasflasche Kunststoffummantelte Glasflasche Glasflasche |
- 10754361 - 10407440 10010010 - 10181460 |
- 10794741 - 10660131 10660131 - 10500911 |
- - 10398233 - 10629112 - - |
- - 11317080 - 11373230 - - |
- 10799701 - 10616653 - - - |
10055454 10489553 - 10001334 - - - |
| Methanol GHS:Entx. Flüüss.Liq.2, Akut Tox.3, STOT SE 1 |
500 ml 1 l 1 l 2,5 l 2,5 l 4 l 5 l |
Glasflasche Glasflasche Kunststoffummantelte Glasflasche Kunststoffummantelte Glasflasche Glasflasche |
- 10012080 - 10499560 10000280 - 10487322 |
- 1037171 - 10449380 10257243 - - |
- - 10144953 - 10670263 - - |
- - 11307090 - 11357090 - - |
- 10434902 - 10777404 - - - |
10636545 10031094 - 10767665 - - - |
| Wasser | 500 ml 1 l 1 2,5 l 2,5 l 4 l 5 l |
Glasflasche Glasflasche Kunststoffummantelte Glasflasche Kunststoffummantelte Glasflasche Glasflasche |
- 10367171 - 10449380 10257243 - - |
- 10367171 - 10449380 10257243 - - |
- - 10327873 - 10221712 - - |
- - 11307090 - 11357090 - - |
- 10434902 - 10777404 - - - |
10095164* 10728098* - 10505904* - - - |
| Gefiltert auf: | 0,2μm | 0,2μm | 0,2μm | 0,1μm | 0,2μm | 0,1μm * 0,03μm |
||
Diese Tabelle hilft Ihnen die passenden Chromatographie Vials und Verschlüsse für Ihren Autosampler zu finden.
Hier finden Sie Angaben zur chemischen Beständigkeit.
Verlassen Sie sich auf Fisherbrand und Fisher Chemical Produkte für jeden Schritt Ihres Chromatographie-Arbeitsablaufs.
Verlassen Sie sich auf Fisherbrand, Fisher Chemical und Fisher BioReagents für jeden Schritt Ihres Arbeitsablaufs.
Verlassen Sie sich auf Fisherbrand, Fisher Chemical und Fisher BioReagents für jeden Schritt Ihres Arbeitsablaufs.
Für jeden Schritt Ihrer Wasseranalyse können Sie sich auf Produkte von Fisherbrand, Fisher Chemical und Fisher Bioreagents verlassen.


.jpg-650.jpg)









