Nukleophile aromatische Substitution
Die nukleophile aromatische Substitution ist ein äußerst nützliches Werkzeug für die Funktionalisierung von Arylverbindungen. Es gibt sie seit Anfang der 1950er Jahre und ist immer noch sehr verbreitet in der Praxis der organischen Synthese, obwohl modernere Methoden zur Kupplung von Stickstoff und aromatischem Kohlenstoff, wie die Buchwald-Hartwig-Kreuzkupplung in den letzten zehn Jahren an Popularität gewonnen haben.
Wie bei allen Substitutionsreaktionen verdrängt ein Nukleophil wie ein Amin oder ein Alkohol eine Abgangsgruppe am aromatischen Ring, meist ein Halogenid.
Es gibt mehrere verschiedene Mechanismen, die mit der nukleophilen aromatischen Substitution verbunden sind. Nur drei haben einen praktischen Bezug zur organischen Synthese:
- Additions-Eliminierungs-Mechanismus
- Arin-Mechanismus
- Aromatische SN1 von Diazoniumsalzen
Der SNAr- bzw. der Additions-Eliminierungs-Mechanismus ist die häufigste Reaktion, die bei den meisten substituierten Arylhalogeniden auftritt. Die elektronenziehende Wirkung des Substituenten erleichtert die Addition des Nucleophils am Ring, indem er die negativ geladenen Zwischenprodukte vor der Eliminierung der Abgangsgruppe stabilisiert.

Der Arin-Mechanismus ist relevant für unsubstituierte Arylhalogenide und verläuft über ein Arin-Zwischenprodukt gemäß dem folgenden Schema:

Schließlich tritt die aromatische SN1 im Fall von aromatischen Diazoniumsalzen über die Bildung eines Arylkations-Zwischenprodukts durch die Eliminierung von N2 und der anschließenden Zugabe des Nukleophils zum Substitutionsprodukt auf.
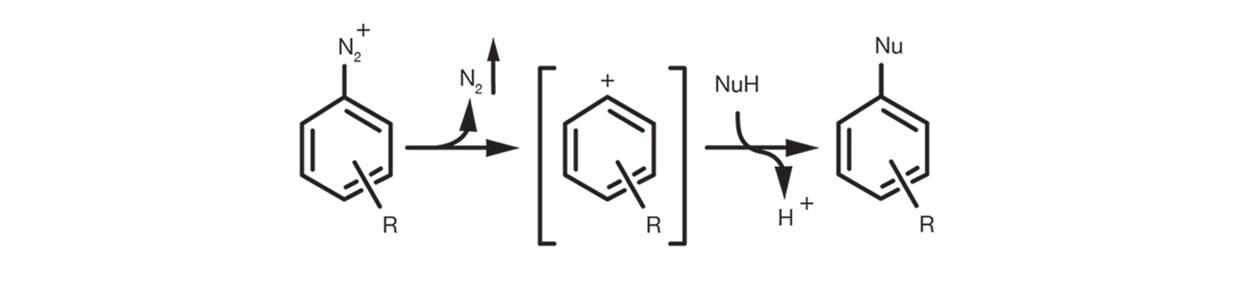
Die Reaktion ist recht einfach. Sie wird in der Regel in relativ polar organischen Lösungsmitteln, protischen and aprotischen, durchgeführt, wie z. B. DMSO, Ethanol, DMF, NMP. Sie wird durch die Verwendung einer Hilfsbase (tertiäre Amine und Carbonate sind die häufigsten) unterstützt und erfordert selten signifikanten Überschuss an Nukleophilen.
Referenz-Reaktionsprotokolle
1. Äquimolare Mengen an Arylhalogenid und Amin (5-50 mmol) abwiegen. 1,5-2 Äquivalente Kaliumcarbonat (oder alternative Base) in Ethanol zugeben. Unter Rückfluss 8-24 Stunden erwärmen.
Anilinderivate können in der Regel durch pH-Shift leicht ausgefällt werden.
2. Äquimolare Mengen an Arylhalogenid und Alkohol abwiegen, in THF lösen und 1,5 Äquivalente Natriumhydrid suspendieren. 8-24 Stunden lang rühren. Die Reaktion kann bei Raumtemperatur ablaufen, jedoch ist es oft erforderlich, auf 80-100 °C zu erwärmen.
Etherprodukte werden in der Regel durch Extraktion mit Wasser, polaren oder apolaren Lösungsmitteln getrennt. Zum Entfernen von Wasser wird häufig Magnesiumsulfat und zum Entfernen von flüchtigen Bestandteilen wird Vakuum verwendet.
Thiole können effektiv als Nukleophile eingesetzt werden, und das Reaktionsprotokoll ist typischerweise das gleiche wie für die Alkohole.
3. Das Arylhalogenid, einen leichten Überschuss an Kaliumcyanid (1,1-1,3 Äquivalente) und eine äquimolare Menge an Trimethylamin in DMSO lösen. Die Reaktion bei etwa 50 °C 12-24 Stunden lang rühren und Wasser tropfenweise zugeben.
Reaktionsprodukte können in Wasser verdünnt und mit Ethylacetat oder anderen polar aprotischen Lösungsmitteln extrahiert werden.
Häufig ist eine chromatographische Aufbereitung erforderlich
Beispiele
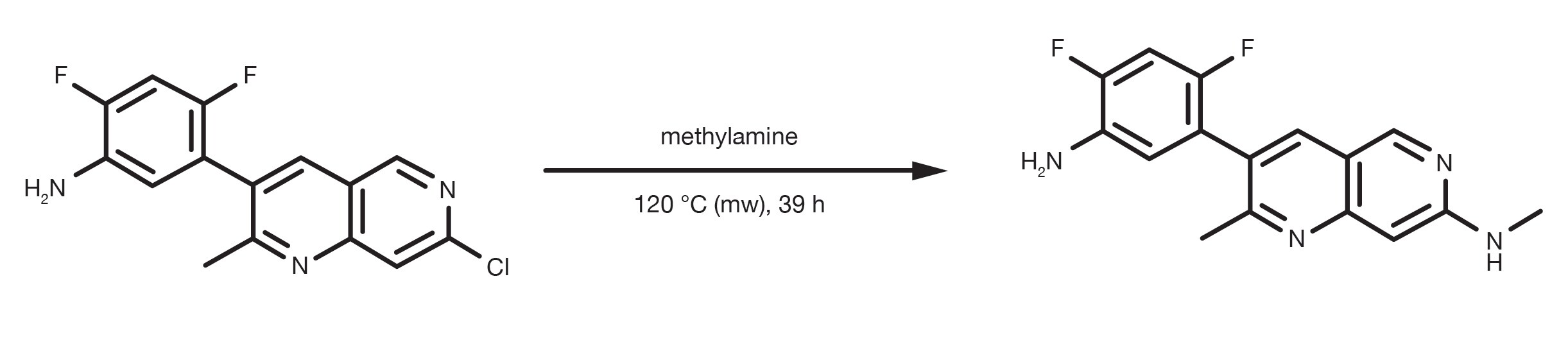
Patentreferenz: WO2013134298

Patentreferenz: WO2014149164
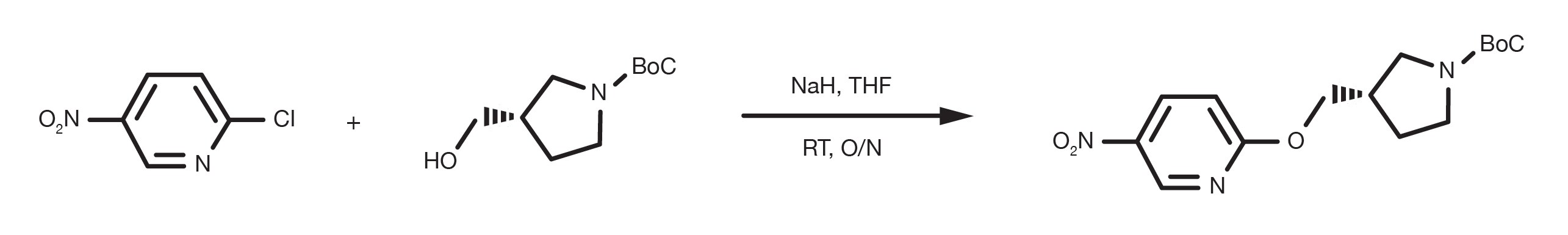
Patentreferenz: WO2016012477
Relevante Literaturhinweise:
- Chem. Rev., 1951, 49 (2): 273–412. https://doi.org/10.1021/cr60153a002
- Molecules 2006, 11, 130-133. https://doi.org/10.3390/11020130
Produktauswahl
Lösungsmittel:
Grundzutaten/Zusatzstoffe:
Laugen:
1,4-Diazabicyclo[2.2.2]octan (DABCO)
Katalysatoren:
Kieselgel kann als Katalysator in einigen Hochtemperaturreaktionen von unsubstituiertem Chlorbenzol verwendet werden
Bausteine:
(poly)substituierte Arylhalogenide:
N-Heteroarylhalogenide:
(Hetero)Aryl-Diazoniumsalze:
4-Nitro-Benzoldiazonium-Tetrafluorborat
4-Methoxy-Benzenediazonium-Tetrafluorborat
4-Bromo-Benzenediazonium-Tetrafluoroborat
Nukleophile:
Amine (primäre, sekundäre und tertiäre)
Andere primäre aromatische Amine
Sekundäre aliphatische Alkohole
Aromatische Alkohole (verschieden substituierte Phenole):
Thiole:
Andere Nukleophile:







